
La última crisis alimentaria ligada a una intoxicación provocada por
E. coli O104 enterohemorrágico en Alemania
(ver enlace) y que ha afectado a otros países de Europa ha puesto de manifiesto una vez más la necesidad de disponer de métodos rápidos y eficaces para la detección de microorganismos de riesgo, tanto para garantizar la salud del consumidor de forma preventiva y evitar la alarma social como para poder identificar de forma inequivoca los alimentos implicados en los brotes, permitiendo por una parte su retirada efectiva del mercado y por otra evitar cierres de mercados no justificados que provocan importantes pérdidas económicas.
Introducción
La contaminación por E. coli enterotoxigénicos ha sido habitualmente asociada a productos cárnicos procedentes de vacuno cocinados inadecuadamente así como a leche cruda, aunque en los últimos diez años también se han detectado casos en productos cárnicos fermentados (salami), mayonesa y yogur. También se ha detectado un incremento de casos relacionados con el consumo de frutas y hortalizas que han podido ser fertilizadas con estiércol de rumiantes o contaminada durante su cosechado o procesado. La dosis de infección de este tipo de microorganismos para producir una toxiinfencción alimentaria, ha sido estimada en niveles muy bajos, lo que explica que puedan producirse contagios entre personas, a través del agua e incluso durante su manipulación en el laboratorio, por lo que este tipo de cepas de E. coli está clasificado como un microorganismo de categoría 3 que debe ser manipulado en un laboratorio de seguridad que cumpla con este requisito.
La intoxicación se manifiesta entre los 3 y 8 días después de consumido el alimento contaminado, puede producir diarrea sanguinolenta y síndrome hemolítico y urémico (HUS), gastroenteritis aguda acompañada de fiebre y ocasionalmente vómitos.
Estos microorganismos se caracterizan por la producción de potentes citotoxinas que inhiben la síntesis de proteína en las células. Estas toxinas se conocen con el nombre de Vero-citotoxinas o Shiga-toxinas que son las que dan nombre a las cepas de Escherichia coli productoras de toxina Shiga (Shiga Toxin –producing Escherichia coli que se suelen denominar por sus siglas en inglés “STEC”), que es un término sinónimo de VTEC (Verocytotoxin producing Escherichia coli).
Dentro de aquellas cepas STEC se encuentran un subgrupo de serotipos que se conocen como enterohemorrágicos o EHEC. La mayoría de enfermedades severas viene causadas por el serogrupo O157, pero se han detectado también asociadas a O26, O111, O103, O145 o como en el caso producido en Alemania por O104.
Límitaciones de los métodos de detección convencionales
Si bien existen numerosos métodos de referencia y alternativos para la detección de microorganismos de origen fecal como Enterobactericeae, Coliformes o bien Escherichia coli en alimentos, debemos tener muy en cuenta que este tipo de bacterias STEC tienen características muy diferentes al resto de bacterias del grupo, por lo que la gran mayoría de los métodos convencionales no permiten la detección de Escherichia coli enterotoxigénico o STEC, como pueden ser decir E. coli O157, O104 etc…
Un claro ejemplo son las normas internacionales de referencia para la detección de Escherichia coli en alimentos (ISO 7251:2005, ISO 16649-3:2005) que indican explícitamente que “las cepas de Escherichia coli que no crecen a 44 °C y en particular, aquellas que sean β-glucuronidasa negativas, tales como Escherichia coli O157 y otras cepas patogénicas de E. coli, no serán detectadas por este método”. Ello es debido a que estos métodos no está diseñado para tal fin, y por ello emplean determinados parámetros como temperaturas de incubación (44ºC) así como indicadores empleados en los medios de cultivo (ejm. actividad beta-glucuronidasa) que no son adecuados para estos STEC. Además, y como se ha indicado anteriormente, su baja dosis infectiva unido a la posible presencia de flora interfiriente (otras cepas de E. coli) hacen desaconsejar totalmente estas técnicas.
En relación con la detección de STEC mediante técnicas de cultivo y otros métodos alternativos, indicar que estos se han centrado principalmente en la detección única y exclusivamente de E. coli O157 y no de otros STEC “no-O157”. Un ejemplo claro lo tenemos en la Norma ISO 16654:2001, que se ha desarrollado para la detección E. coli O157 y para ello incorpora una etapa de inmunoconcentración después de enriquecimiento específico del serogrupo O157, para después proceder al aislamiento en medios de agar selectivo sobre los que realizar una confirmación posterior en caso de presencia de colonias típicas.
También otros métodos alternativos basados en el empleo de anticuerpos o análisis moleculares se han diseñado para la detección específica de cepas de E. coli O157.
Método para la detección de E. coli STEC (incluyendo E. coli O104)
Frente a las limitaciones que se han indicado de los métodos convencionales, las técnicas moleculares destacan por la posibilidad de diseñar un método en el que se pueda detectar de forma sensible y específica la bacteria objeto de estudio en un plazo corto (menos de 24 horas) con un coste ajustado. El empleo de métodos como la PCR a Tiempo Real es el que sirve de base para muchas técnicas de detección de patógenos, entre las que se encuentran la detección de STEC incluyendo los E. coli enterohemorrágicos.
Por todas las limitaciones anteriormente fijadas y ante la aparición cada vez más frecuente de cepas STEC tanto de
E. coli O157 como “no-O157” surgió una iniciativa dentro del subcomité ISO y CEN para el desarrollo de métodos analíticos microbiológicos (ISOTC34/SC9; CEN 275/WG06), liderada por el Laboratorio de Referencia de la UE para E. coli Verotoxigénicos (
http://www.iss.it/vtec/chis/index.php?lang=2&tipo=1&anno=2011) para la futura publicación de una norma ISO que permita la detección en alimentos de
E. coli productores de toxina Shiga, asi como de las principales toxinas relacionadas y por tanto que suponen un potencial riesgo para la salud. En este borrador de trabajo nos basamos para realizar la puesta a punto e incorporación a nuestro laboratorio de un método para la “Detección de
E. coli O157 y otros
E. coli enterotoxigénicos productores de toxina Shiga (STEC)”
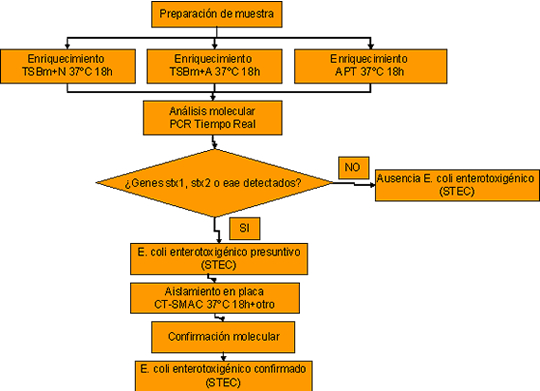
Para la ejecución del método y su implantación en laboratorios se han seguido las directrices de diferentes normas como la ISO 17025, ISO 7218 así como Normas específicas para análisis microbiológico molecular como la ISO 22174 entre otras.
El método analítico consiste en primer lugar en la preparación de muestra de alimentos acorde a los protocolos habitualmente establecidos en función del tipo de matriz objeto de análisis (según la serie de normas ISO 6887). Posteriormente se somete la muestra a un enriquecimiento a 37ºC durante 18 horas, en el que pueden emplearse diversos caldos:
• TSB modificado adicionado con acriflavina para productos lácteos.
• Agua de peptona tamponada para muestras que puedan contener cepas estresadas como alimentos congelados y con poca microflora acompañante.
• TSB modificado adicionado con novobiocina, en el caso de muestras con altos niveles de flora acompañante. Destacar en este caso que el empleo de novobiocina como agente selectivo es controvertido puesto que a ciertas dosis este antibiótico puede ser inhibitorio para cepas STEC “no-O157”, por lo que su concentración debe ser adaptada para alcanzar un balance óptimo entre la inhibición de la posible flora acompañante (bacterias gram positivas) y el crecimiento de todas las cepas STEC.
Después del enriquecimiento se realiza una extracción de ácidos nucleicos y purificación de los mismos y por último la amplificación y detección simultánea de fragmentos genéticos propios de las STEC.
Los genes seleccionados en una primera fase de cribado son los genes stx1 y stx2 que codifican la toxina Shiga, siendo el gen stx2 el que se ha asociado más habitualmente con enfermedades graves en humanos, así como del gen eae que codifica la intimina relacionada con el mecanismo de adhesión de la bacteria.
Por lo que la presencia de al menos uno de estos genes indica la presencia presuntiva de STEC en la muestra analizada.
En posteriores etapas y a partir de muestras positivas, se procede al aislamiento en medios de cultivo adecuados, como el medio CT-SMAC (Agar Cefiximida telurito sorbitol McConkey) incubado a 37ºC durante 24-48 horas, así como otros medios a elección del laboratorio.
La presencia de colonias típicas en estos medios de cultivo en las que se confirma la existencia de alguno de estos genes, permite concluir la presencia de STEC potencialmente patogénicos en la muestra analizada.
Todas estas etapas analíticas incorporan controles analíticos que permiten garantizar la fiabilidad de la técnica mediante el empleo de controles internos para detectar inhibiciones de la señal de PCR, de cepas de referencia con resultados positivos así como controles negativos para comprobar la ausencia de contaminaciones cruzadas en el laboratorio.
Formación relacionada con este artículo


