
El empleo de métodos de PCR para la detección de microorganismos en alimentos, viene condicionado por una adecuada elección de la técnica así como la adecuación de la infraestructura y equipos del laboratorio y el empleo de métodos adaptados a las necesidades del laboratorio, validados e incluso desarrollados como métodos de referencia ISO, tal y como describimos a continuación.
60 años después de la publicación de la estructura del ADN, de todas las técnicas de biología molecular desarrolladas en este período, han sido las basadas en amplificación de secuencias específicas de DNA mediante la reacción en cadena de la polimerasa (PCR), descubierta hace poco más de 25 años, las que han revolucionado múltiples áreas de la ciencia relacionadas con la manipulación de ácidos nucleicos, incluida la del diagnóstico microbiológico y se han convertido en una alternativa válida a los métodos basados en caracteres fenotípicos en los que se basan muchos métodos de referencia.
El desarrollo de métodos adaptados a las necesidades de los laboratorios y las industrias alimentarias, los avances en los sistemas de calidad y en la normalización y validación de estos métodos están permitiendo un uso cada vez más intensivo para garantizar la seguridad y calidad de los alimentos de una forma rápida, segura y a un precio razonable.
Etapas de un método de PCR para detección de microorganismos
Si bien son múltiples las variantes que existen sobre la técnica de la PCR, para la detección de microorganismos en alimentos se emplean básicamente la PCR “convencional” (con electroforesis en gel de agarosa) (Fig 1.) y principalmente la PCR a Tiempo Real en la que las fases de amplificación y detección de realizan simultáneamente (Fig. 2)
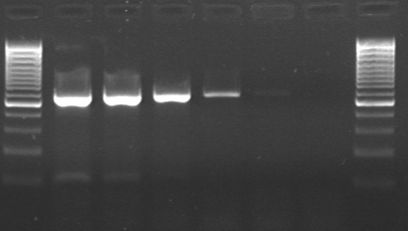
(Fig 1: Gel agarosa)
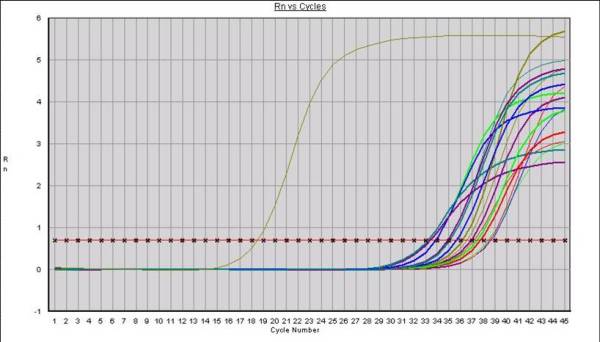
Fig. 2: Gráfica de amplificación mediante PCR Tiempo Real
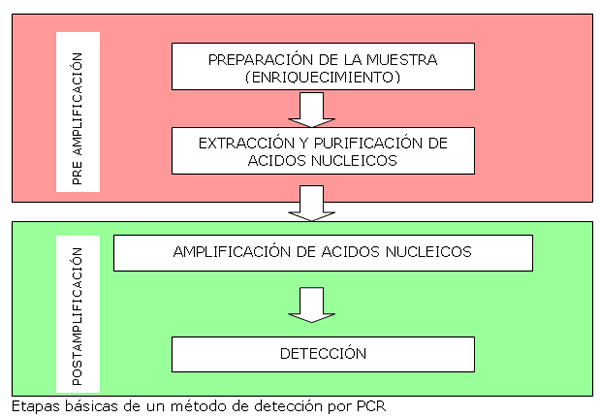
En muchos casos, y principalmente para las técnicas de investigación (presencia/ausencia) el método lleva asociada una etapa previa de enriquecimiento de la muestra mediante cultivo que permite incrementar la concentración de microorganismos diana y reducir la cantidad de inhibidores presentes en el alimento. En algunos casos esta etapa se realiza por otros métodos (ejm. concentración por filtración) o no es necesaria (ejemplo en el caso de la detección de virus)
Por otra parte, aunque no necesariamente, ante la presencia de resultados positivos, la técnica se puede complementar con una detección mediante técnicas de referencia por cultivo, de modo que se evita la posibilidad de falsos positivos por la presencia de fragmentos de ADN y células no viables.
Implantación en el laboratorio de análisis
Aunque en sus inicios se podía considerar una técnica cara y compleja, podemos afirmar sin temor a equivocarnos que actualmente este tipo de análisis están al alcance de la mano de cualquier laboratorio de control de calidad.
Por una parte, la inversión inicial en adecuación del laboratorio es mínima, considerando que si bien debemos disponer de una clara separación y un adecuado flujo de personal y materiales entre dos grandes áreas de actividad como son las:
• actividades realizadas en zonas anteriores a la amplificación (PREAMPLIFICACIÓN)
• actividades realizadas durante y después de la amplificiación (POSTAMPLIFICACIÓN)
En el caso del empleo de métodos comerciales y sobre todo gracias a la técnica de PCR a Tiempo Real, donde la amplificación y detección se realiza en un tubo sin necesidad de abrirlo en ningún caso, esta infraestructura se limita generalmente a poco más que una cabina de flujo laminar para realizar las mezclas de reactivos de amplificación y la muestra objeto de análisis.
Así pues, si disponemos de un laboratorio de microbiología, la mayoría de equipos e infraestructura será válida para los análisis moleculares, debiendo únicamente invertir en los equipos específicos que se pueden limitar a:
• Microcentrífuga
• Termociclador
• Electroforesis y transiluminador (no necesarios en caso de PCR a Tiempo Real)
Estos equipos suponen una inversión en equipos de menos de 10.000 Euros en el caso de la PCR convencional y de en torno a 25.000-35.000 euros si hablamos de PCR a Tiempo Real, debiendo considerar que en muchos casos, esta inversión inicial es fácilmente amortizable por el ahorro en mano de obra, reactivos y plazo de obtención de resultados.
Desarrollo y validación de métodos
Una de las razones que ha limitado el empleo de estos métodos en el laboratorio ha sido la falta de métodos oficiales basados en PCR. Sin embargo, en la actualidad, el Reglamento relativo a los criterios microbiológicos aplicables a los productos alimenticios (Reglamento (CE) nº 2073/2005 de 15 de noviembre de 2005, DOCE L 338 22/12/05) se recoge en su considerando 24 que “los explotadores de las empresas alimentarias pueden usar métodos analíticos diferentes a los métodos de referencia, en particular métodos más rápidos, siempre que estos métodos alternativos produzcan resultados equivalentes”
Así pues desde un punto de vista legal se reconoce el empleo de este tipo de métodos en el ámbito de la legislación actual, si bien posteriormente incluye en el artículo 5 punto 5 que “Se autorizará el uso de métodos alternativos cuando los métodos estén validados con respecto al método de referencia establecido en el Anexo I y si se utiliza un método registrado, certificado por terceros conforme al protocolo de la norma EN/ISO 16140 u otros protocolos similares internacionalmente aceptados.”
Son precisamente estos métodos moleculares, entre otros, los que se pueden considerar métodos alternativos, pues permiten obtener resultados de forma más rápida de manera equivalente al método de referencia, siempre que se haya comprobado su validez acorde a la norma descrita (ISO 16140). Esta validación de puede realizar de forma específica para el método que el laboratorio desea emplear o bien puede seleccionarse un método que ya haya sido validado o certificado previamente, tal y como realizan las siguientes organizaciones de certificación en las cuales se puede consultar los métodos validados y certificados:
• AFNOR
• MICROVAL
• AOAC
• NORDVAL
También para aquellos laboratorios que disponen de un sistema de calidad basado en la ISO 17025, vemos que en esta se reconoce que (apartado 5.4.2 ) que “El laboratorio debe utilizar métodos de ensayo que satisfagan las necesidades del cliente y sean apropiados para el uso previsto” y que “el laboratorio debe seleccionar los métodos apropiados que hayan sido publicados en normas internacionales, regionales o nacionales, por organizaciones técnicas reconocidas o en libros o revistas científicas especializados o especificados por el fabricante de equipos”
En este caso y en relación con la posible acreditación de este tipo de métodos, la Entidad Nacional de Acreditación (ENAC) reconoce la posibilidad de empleo de estos métodos (NT-32) tanto si se han validado previamente (considerándolos Métodos alternativos o “Tipo II”) como si el laboratorio los has desarrollado y validado adecuadamente (Métodos “Tipo IV”)
Además, los métodos moleculares permiten una mayor automatización, además de incorporar controles internos para garantizar la adecuada realización de los ensayos, evitando los falsos negativos debidos a posibles inhibiciones o mal funcionamiento del sistema así como reducen la necesidad de interpretación gracias a la evaluación objetiva de los resultados obtenidos.
Métodos Normalizados y de Referencia
Por último, y al objeto de facilitar el uso de estas técnicas por los laboratorios, los organismos internacionales de normalización también están trabajando en el desarrollo de este tipo de métodos y en la publicación de normas.
En este sentido y dentro de los Comités de la Organización Internacional de Normalización (ISO) y del Comité Europeo de Normalización (CEN) existe un Grupo de Trabajo Horizontal (CEN TC275/WG6/TAG3) para el desarrollo de Guías y Documentos, que ha desarrollado los siguientes documentos que marcan requisitos generales para la implantación de métodos de PCR para la detección de microorganismos en alimentos, piensos y muestras ambientales:
• ISO/TS 20836:2005: Criterios de funcionamiento de los termocicladores.
• ISO 22174:2005 Requisitos generales y definiciones para técnicas de PCR.
• ISO 20837:2006: Requisitos para la preparación de muestras para la detección cualitativa.
• ISO 20838:2006: Requisitos para la amplificación para la detección cualitativa.
• ISO 22118:2011: Criterios de funcionamiento para detección y cuantificación de microorganismos.
• ISO 22119:2011: Requisitos generales y definiciones para técnicas de PCR a Tiempo Real.
Personalmente recomiendo consultar básicamente y en primer lugar la norma ISO 22174 pues es donde se establecen los criterios generales que después son utilizados en las otras normas específicas, siendo el resto de normas una recopilación más o menos genérica del funcionamiento de la PCR habitualmente conocidas.
Además de esas normas, y en aquellos casos en los que los métodos convencionales de cultivo no son adecuados o presentan limitaciones. En este sentido y también con carácter general, la Norma ISO 7218:2007, (apartado 12.5) indica que se pueden utilizar sondas de ácidos nucleicos como complemento a los métodos convencionales para la confirmación de colonias, previa validación de esta técnica.
Además, se dispone de los siguientes métodos de ensayo que emplean técnicas moleculares:
• ISO/TS 13136:2012: Horizontal method for the detection of Shiga toxin-producing Escherichia coli (STEC) and the determination of O157, O111, O26, O103 and O145 serogroups
• ISO/TS 15216-1 y 2:2013: Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR — Part 1: Method for quantification; Part 2: Method for qualitative detection
• ISO/TS 17919 (en proyecto): Detection of botulinum type A, B, E, and F neurotoxin-producing clostridia
Todos estos documentos, validaciones y métodos pueden ampliarse con documentación técnica así como con numerosas jornadas (Jornadas MRAMA), cursos y congresos donde se exponen los más recientes avances en este campo.
Para finalizar y a modo de experiencia personal, nuestro laboratorio apostó por la implantación de estos métodos hace ya más de 10 años, contemplando tanto su uso como métodos de referencia (por ejemplo para la detección de virus entéricos o STEC) como para el desarrollo de métodos alternativos tanto para la detección de microorganismos en alimentos (patógenos y alterantes) como para la confirmación de colonias obtenidas en los métodos de referencia. En la actualidad todos estos métodos están acreditados y se realizan más de 40.000 ensayos al año, permitiendo ofrecer un servicio optimizado en cuanto a calidad, plazo de entrega y precio.

